高考化学知识点总结(九):关于金属元素及其化合物
来源:未知发布时间:2018-12-21
最近一轮复习开始了,化学姐为大家整理了高考化学的知识点,今天是第11部分。
二.金属元素及其化合物
(一)金属元素概述
1.金属元素在周期表中的位置及原予结构特征
(1)金属元素分布在周期表的左下方,目前已知的112种元素共有90种金属元素。
(2)金属元素最外层电子数一般小于4个。(Ge、Sn、Pb 4个Sb、Bi 5个,Po 6个)原子半径较同周期非金属原子半径大。
(3)金属元素形成的金属单质固态时全是金属晶体。
2.金属的分类
(1)冶金工业上黑色金属:Fe、Cr、Mn(其主要氧化物呈黑色)。有色金属:除Fe、Cr、Mn以外的所有金属。
(2)按密度分
轻金属:ρ<4.5g·cm–3(如Na、Mg、A1)
重金属:ρ>4.5g·cm–3(如Fe、Cu、W)
(3)按存在丰度分常见金属:如Fe(4.75%)、Al(7.73%)、Ca(3.45%)等稀有金属:如锆、铪、铌等。
3.金属的物理性质
(1)状态:通常情况下,除汞外其他金属都是固态。
(2)金属光泽:多数金属具有金属光泽。
(3)易导电一导热:由于金属晶体中自由电子的运动,使金属易导电、导热。
(4)延展性:可压成薄片,也可抽成细丝。
(5)熔点及硬度:由金属晶体中金属离子和自由电子的作用强弱决定。最高的是钨(3413℃),最低的是汞(–39℃)。
4.金属的化学性质
(1)与非金属单质作用
(2)与H2O作用
(3)与酸作用
(4)与碱作用(仅Al、Zn可以)
(5)与盐的作用
(6)与某些氧化物作用
5.金属的冶炼 (1)热分解法(适用于不活泼金属)
2HgO=2Hg+O2↑ 2Ag2O=4Ag+O2↑
(2)热还原法(常用还原剂CO、H2、C活泼金属等)
Fe2O3+3CO=2Fe+3CO2Cr2O3+2Al=2Cr+A12O3
(3)电解法(适用于非常活泼的金属)
2A12O3=4Al+3O2↑ 2NaCl=2Na+Cl2↑
(二)碱金属元素
1.钠及其化合物
(1)钠的物理性质
钠是一种柔软、银白色,有金属光泽的金属,具有良好的导电、导热性,密度比水小,比煤油大,熔点较低。
(2)钠的化学性质
①与非金属反应
2Na + Cl22NaCl
2Na + O2Na2O2(黄色火焰)
4Na+O2=2Na2O(空气中,钠的切面变暗)
②与水反应
2Na+2H2O=2NaOH+H2↑
现象及解释:浮在水面上——密度比水小;熔化成小球——钠的熔点低,反应放热;四处游动——生成气体;酚酞变红——生成碱。
③与酸反应
2Na+2H+=2Na++H2↑ 钠不足,直接与酸反应;钠过量,先与酸反应再与水反应。
④与盐溶液反应
钠与盐溶液反应,先考虑Na与水反应生成NaOH,再考虑NaOH是否与盐反应。
a.投入NaCl溶液中,只有H2放出。2Na+2H2O=2NaOH+H2↑
b.投入饱和NaCl溶液中,有H2放出,还有NaCl晶体析出(温度不变))。
c.投入NH4Cl溶液中,有H2和NH3逸出。
2Na+2NHCl=2NaCl+2NH3↑+H2↑
d.投入CuSO4溶液中,有气体放出和蓝色沉淀生成。
2Na+H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑
(3)钠的保存及用途:
①保存:钠的化学性质非常活泼,易与空气中的O2、H2O等反应,保存在煤油中。
②用途:
a.工业上用于冶炼金属:4Na+TiCl4=Ti+4NaCl
b.Na—K合金(液态)用作原子反应堆的导热剂
c.制造高压钠灯,作为电光源。
2.碱金属元素
(1)周期表中的位置:第IA族(Li、Na、K、Rb、Cs)
(2)原子结构特点:最外层电子数均为1。
(3)主要性质:
①原子半径为同周期最大,易失电子。强还原剂且从Li→Cs金属性增强。
②取高价氧化物的水化物呈强碱性,从Li→Cs碱性增强。
(三)镁、铝、铁及其化合物
1.镁、铝在元素周期表中位置及原子结构镁(Mg):位于周期表第3周期第IIA原子结构铝(Al):位于周期表第3周期第IIIA,原子结构Mg、Al均为活泼金属,在化学反应中都易失电子,其性质有相似之处,但由于原子结构不同性质上也有差异。
2.镁、铝的物理性质
①相同点:密度较小,熔点较低、硬度较小、均为银白色。
②不同点:铅的硬度比镁稍大,熔沸点比镁高,这是由于镁、铅的金属键的强弱不同。
3.镁、铝的化学性质比较:
|
Mg |
Al |
|
|
暴露在空气中(与O2反应) |
常温下被O2氧化,形成致密氧化膜、因而具有一定抗腐蚀性 |
很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强 |
|
燃烧 |
空气中点燃,发出耀眼的白光 2Mg + O2 2MgO |
在纯氧中或高温下可燃烧 4Al + 3O2 2Al2O3 |
|
与某些氧化物反应 |
2Mg +CO2 2MgO + C |
4Al+3MnO22Al2O3+3Mn 2Al+Fe2O3Al2O3+2Fe |
|
与H2O反应 |
Mg+2H2OMg(OH)2↓+H2↑ |
与沸水只有微弱反应 |
|
与非金属反应 |
3Mg + N2 Mg3N2 |
2Al+ 3Cl22AlCl3 |
|
与非氧化性酸反应 |
Mg + 2HCl = MgCl2+ H2↑ |
2Al + 6HCl = 2AlCl3+ 3H2↑ |
|
与氧化性酸反应 |
能反应,无 H2生成 |
4.氧化铝和氢氧化铝
A12O3和Al(OH)3是典型的两性化合物,既能与强酸反应。也能与强碱反应生成盐和H2O。
Al 2O3+6H+=2A13++3H2O A12O3+2OH–=2A1O2–+H2O
Al(OH)3+3H+=A13++3H2O Al(OH)3+OH–=A1O2–+2H2O
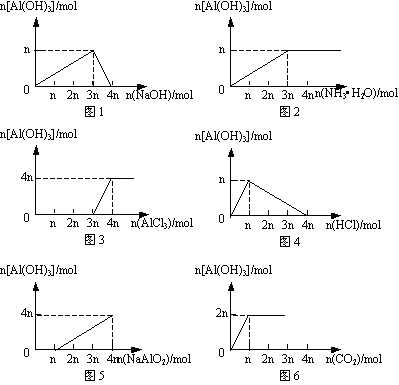
5.生成Al(OH)3沉淀量的图像分析
(1)向AlCl3溶液中滴加NaOH溶液直至过量。图1所示。(2)向AlCl3溶液中滴加氨水至过量。图2所示。(3)向NaOH溶液中滴加AlCl3溶液直至过量。图3所示。(4)向NaAlO2溶液中滴加盐酸直至过量。图4所示。(5)向盐酸中滴入NaAlO2溶液直至过量。图5所示。(6)向NaAlO2溶液中通人CO2直至过量。图6所示。
6.铁及其化合物
(1)铁在周期表中的位置及原子结构
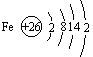
铁位于第四周期第Ⅷ族,是过渡金属元素的代表,其原子结构示意图:铁元素是一种变价元素,通常显示+2价、+3价,其化合物及其水溶液往往带有颜色。
(2)铁的性质
①与非金属反应
2Fe+3Cl2=2FeCl3(棕黄色的烟)
3Fe+2O2=Fe3O4
Fe+S=FeS
Fe+I2=FeI2
注:铁与弱氧化性物质反应生成低价铁的化合物
②与酸反应
a.非氧化性酸.Fe+2H+=Fe2++H2↑
b.氧化性酸:常温下遇浓H2SO4、浓HNO3会发生钝化,而加热时会剧烈反应。
③与水反应:3Fe+4H2O(气)=Fe3O4+4H2
④与某些盐熔液反应:Fe+Cu2+=Fe2++Cu,Fe+2Fe3+=3Fe2+
(3)铁的存在铁在自然界中分布较广。在地壳中含量约占5%,仅次于铝。分布在地壳中的铁均以化合态存在,游离态的铁只能在陨石中得到。铁矿石的种类较多,重要有:赤铁矿(Fe2O3)、磁铁矿(Fe3O4),褐铁矿(2Fe2O3·3H2O)和菱铁矿(FeCO3)。
(4)铁的氧化物和氢氧化物
①铁的氧化物
|
FeO |
Fe2O3 |
Fe3O4 |
|
|
俗称 |
—— |
铁红 |
磁性氧化铁 |
|
色、态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
|
化合价 |
+2 |
+3 |
+2、+3 |
|
水溶性 |
均难溶于水 |
||
|
稳定性 |
不稳定 6FeO+O2=2Fe3O4 |
稳定 |
稳定 |
|
与酸反应 |
FeO+2H+=Fe2++H2O |
Fe2O3+6H+= 2Fe3++3H2O |
Fe3O4+8H+= Fe2++2Fe3++ 4H2O |
|
与CO的反应 |
FexOy+yCO=xFe+yCO2 |
||
|
制取 |
高温熔融,过量的铁与氧气反应 2Fe+O22FeO |
Fe(OH)3的分解 2Fe(OH)3 Fe2O3+3H2O |
铁在氧气中燃烧 3Fe+2O2Fe3O4 |
②铁的氢氧化物
|
Fe(OH)2 |
Fe(OH)3 |
|
|
物性 |
白色,难溶于水的固体 |
红褐色,难溶于水的固体 |
|
化性 |
(1)与非氧化性强酸反应 Fe(OH)2+2H+=Fe2++2H2O (2)与氧化性酸反应 3Fe(OH)2+10HNO3=3Fe(NO3)3 +NO↑+8H2O (3)空气中放置被氧化 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
(1)与酸反应 Fe(OH)3+3H+=Fe3++3H2O (2)受热分解 2Fe(OH)3=Fe2O3+3H2O |
|
制备 |
①煮沸蒸馏水,赶走溶解的氧气②煮沸NaOH溶液,赶走溶解的氧气③配制FeSO4溶液,加少量的还原铁粉④用长滴管将NaOH溶液送入FeSO4溶液液面以下 Fe2++2OH-=Fe(OH)2↓ |
将NaOH溶液滴入Fe2(SO4)3 溶液中 Fe3++3OH-=Fe(OH)3↓ |
(5)Fe2+和Fe3+的性质
①Fe2+具有氧化性,主要表现还原性
4Fe2++O2+4H+=4Fe3++2H2O(Fe2+被氧化)
②Fe3+具有较强的氧化性,与S2–、I–、SO32– 等能发生氧化还原反应2Fe3++S2–=2Fe2++S↓ 2Fe3++2I–=2Fe2++I2
③Fe3+是典型的弱碱阳离子,与HCO3–、AlO2–。等在溶液中发生双水解反应2Fe+3CO32–+3H2O=2Fe(OH)3↓+3CO2↑
④Fe3+遇苯酚溶液呈紫色;可用于检验Fe3+
⑤亚铁盐、铁盐的存放方法:亚铁盐溶液——加入少量铁屑以防止Fe2+被氧化,滴入少量相应的酸溶液以防止Fe2+水解。铁盐溶液——加入少量相应的酸溶液以防止Fe3+水解。