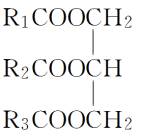高中化学:有机化学基础知识点总结
来源:格瑞斯教育发布时间:2019-04-28
题型1 常见有机物的结构与同分异构体
1.熟记三类分子的空间结构
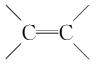
(1)四面体型分子: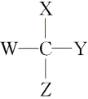
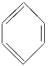
(2)六原子共面分子: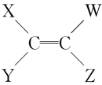
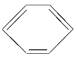
(3)十二原子共面分子: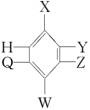
2.同分异构体的书写与数目判断技巧
(1)烃基连接法:甲基、乙基均一种,丙基有2种,丁基有4种。如:丁醇有4种,C4H9Cl有4种。
(2)换元法:如C2H5Cl与C2HCl5均一种。
(3)等效氢法:有机物分子中有多少种等效氢原子,其一元取代物就有多少种,从而确定同分异构体数目的方法。分子中等效氢原子有如下情况:
①分子中同一碳原子上的氢原子等效。
②同一个碳原子上的甲基上的氢原子等效。
③分子中处于镜面对称位置(相当于平面镜成像时)上的氢原子是等效的。
(4)定1移2法:分析二元取代物的方法,先固定一个取代基的位置,再移动另一取代基的位置,从而可确定同分异构体的数目。如分析C3H6Cl2的同分异构体,先固定其中一个Cl的位置,移动另外一个Cl。
3.芳香族化合物同分异构体数目的确定
(1)若取代基在苯环上的位置一定,但取代基种类不确定,同分异构体数目的多少是由取代基的种数决定的,此时分析的重点是苯环上的取代基,如C6H5—C4H9,因为丁基有四种不同的结构,故该烃有四种同分异构体。
(2)若取代基种类一定,但位置不确定时,可按下述方法处理:当苯环上只有两个取代基时,取代基在苯环上的位置有邻、间、对三种;当有三个取代时,这三个取代基有“连、偏、匀”三种位置关系(如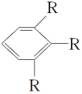 、
、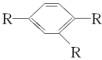 、
、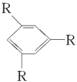 ,R表示取代基,可以相同或不同)。
,R表示取代基,可以相同或不同)。
4.酯类同分异构体的确定
将酯分成RCOO和R′两部分,再按上述方法确定R—和R′—的同分异构体数目,二者数目相乘即得每类酯的同分异构体数目,最后求总数。如C4H8O2属于酯的同分异构体数目的思考程序如下:
HCOOC3H7(丙基2种)1×2=2种
CH3COOC2H5(甲基1种,乙基1种)1×1=1种
C2H5COOCH3(乙基1种,甲基1种)1×1=1种
同分异构体数共有:4种。
题型2 常见有机物的性质和应用
|
物质 |
结构简式 |
特性或特征反应 |
|
甲烷 |
CH4 |
与氯气在光照下发生取代反应 |
|
乙烯 |
CH2===CH2 |
①加成反应:使溴水褪色 ②加聚反应 ③氧化反应:使酸性KMnO4溶液褪色 |
|
苯 |
|
①加成反应 ②取代反应:与溴(溴化铁作催化剂),与硝酸(浓硫酸催化) |
|
乙醇 |
CH3CH2OH |
①与钠反应放出H2 ②催化氧化反应:生成乙醛 ③酯化反应:与酸反应生成酯 |
|
乙酸 |
CH3COOH |
①弱酸性,但酸性比碳酸强 ②酯化反应:与醇反应生成酯 |
|
乙酸乙酯 |
CH3COOCH2CH3 |
可发生水解反应,在碱性条件下水解彻底 |
|
油脂 |
|
可发生水解反应,在碱性条件下水解彻底,被称为皂化反应 |
|
淀粉 |
(C6H10O5)n |
①遇碘变蓝色 ②在稀酸催化下,最终水解成葡萄糖 ③葡萄糖在酒化酶的作用下,生成乙醇和CO2 |
|
蛋白质 |
含有肽键 |
①水解反应生成氨基酸 ②两性 ③变性 ④颜色反应 ⑤灼烧产生特殊气味 |
题型3 根据结构简式推测有机物的分子式和性质
|
官能团 |
主要性质 |
|
|
名称 |
结构 |
|
|
碳碳双键 |
|
①加成反应(使溴的四氯化碳溶液褪色) ②氧化反应(使酸性KMnO4溶液褪色) ③加聚反应 |
|
苯环 |
|
①取代反应(硝化、溴代) ②加成反应(催化加氢) |
|
羟基 |
—OH |
①取代反应(酯化、两醇分子间脱水) ②与金属Na的置换反应 ③氧化反应(催化氧化、使酸性KMnO4溶液褪色) |
|
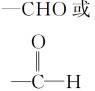
醛基 |
|
①还原反应(催化加氢) ②氧化反应(催化氧化、银镜反应、与新制氢氧化铜悬浊液反应) |
|
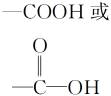
羧基 |
|
①弱酸性 ②酯化反应 |
|
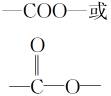
酯基 |
|
水解
|